Очевидна ли связь?
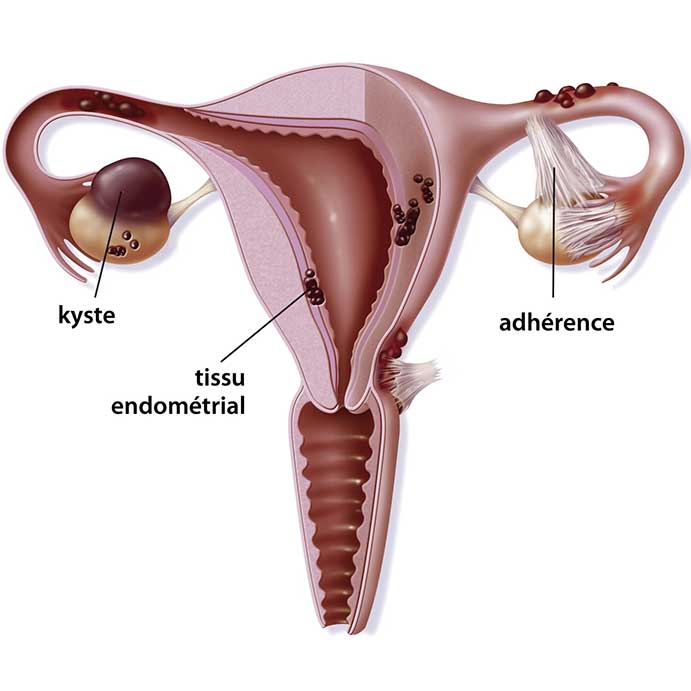
По данным различных источников, частота бесплодия среди супружеских пар во всем мире варьирует в пределах 7-13% и не имеет тенденции к снижению. На долю эндометриоз-ассоциированного бесплодия приходится 25-50% [1-4]. Важно отметить, что возраст пациенток с идентифицированным диагнозом составляет в среднем 28-30 лет, длительность же заболевания к моменту установления в преобладающем большинстве случаев превышает пятилетний порог [5]. Наиболее распространенной формой генитального эндометриоза являются эндометриоидные образования яичников (ЭОЯ).
Стертая - неспецифическая клиническая картина эндометриоза объясняет сложность диагностики заболевания. Первые симптомы обозначенной нозологической единицы кажутся для пациентки малозначимыми, а их появлению предшествует длительное бессимптомное течение.
Несмотря на большой объем исследовательских работ, предлагающих гипотезы этиологии и патогенеза эндометриоза; причины и механизмы формирования инфертильности в настоящее время подвергаются большим сомнениями и широко дискутируются [6-8]. Выделяют несколько факторов, предрасполагающих к развитию бесплодия.
Не вызывает сомнений, что эндометриоидные гетеротопии инициируют асептический воспалительный процесс, влияющий на нормальное течение оогенеза, что характеризуется уменьшением количества и диаметра антральных фолликулов. Существуют исследования доказывающие, что эндометриоидное содержимое имеет свободные радикалы железа, которые участвуют в реакции перекисного окисления (реакция Фентона), приводящей к альтерации фолликулярного пула, чего нельзя сказать о других доброкачественных образованиях яичников (ДОЯ) [6,9].
Увеличение размера эндометриоидной кисты также приводит к ухудшению качества фолликулов за счет механического растяжения морфофункциональной ткани, а также сдавления сосудов, обеспечивающих трофику гонады. Важно отметить, что помимо качества ооцитов, отмечается и снижение их плотности на единицу объема здоровой ткани [10, 11].
Казалось бы, представленные выводы логичны и не вызывают сомнений, что подтверждается согласующимися результатами исследований [12]. Однако в настоящее время появляются данные, противоречащие вышеобозначенным заключениям. Так, например группа ученных во главе с U. L.R.Maggiore et al. утверждает, что число овуляций в пораженном яичнике и коллатеральном не имеют статистически значимой разницы и не зависят от стороны патологического процесса, а также количества и размеров ЭОЯ [13].
К другой причине, приводящей к бесплодию, относится микроперфорация ЭОЯ. Попадание даже небольшого количества гемосидерина в брюшную полость способствует развитию хронического спаечного процесса с вовлечением брюшины. Усугубление спаечной болезни напрямую зависит от количества эндометриодных кист и их размера. Нередко микроразрывы эндометриом проявляют себя клиникой «острого живота». Нет сомнений - ЭОЯ всегда ассоциированы со спаечным процессом, что способствует нарушению нормальной миграции оплодотворенной яйцеклетки [14].
Существуют клинические исследования о развитии эндометриопатий на фоне персистенции энометриоидных образований яичников, что выражается в снижении рецептивности железистого слоя матки, нарушениях его морфологического и функционального состояний [15, 16].
С учетом намеченной тенденции все больше авторов склоняются к выводу о том, что ЭОЯ связаны с высоким риском инфертильности. Оперативное лечение лишь будет способствовать снижению овариального резерва, т.к. доказано, что энуклеация образований сопровождается непреднамеренным удалением части здоровой морфофункциональной ткани [17]. Данные аргументы могут служить основанием в пользу выжидательной тактики.
Большинство исследователей не подвергают сомнению связь между ЭОЯ и репродуктивным потенциалом. Несмотря на это оживленность дискуссий сохраняется. Сообщество специалистов предпринимает попытки прийти к общему соглашению в вопросах лечения пациенток с ЭОЯ с позиции максимального сохранения репродуктивного потенциала. Согласно отечественным клиническим протоколам, все яичниковые образования должный подвергнутся исследованию и оперативно удалены с обязательным патогистологическим исследованием. Логика рекомендаций понятна: ни один врач не даст гарантии того, что при выжидательном ведений больной с ДОЯ он полностью исключает риск малигнизации искомого.