Лучевая терапия (радиотерапия) — один из ведущих методов лечения дегенеративных, воспалительных и гипертрофических образований кожи, а также онкологических заболеваний.[1] По данным ВОЗ (Всемирной организации здравоохранения), в радиотерапии нуждаются 75% пациентов дерматологического и онкологического профилей.[2] В основе метода лежат физические свойства ионизирующего излучения, которое в высоких дозах способно разрушать ДНК клеток, прекращая их жизнедеятельность и размножение.[3] Основные источники ионизирующего излучения в современной лучевой терапии — линейные ускорители, генерирующие фотонные, протонные и электронные радиоволны высокой мощности, и рентгенотерапевтические установки, создающие рентгеновское излучение низких и средних энергий.[4] [5]
Когда и как применяется лучевая терапия при онкологии и какие устройства необходимы для ее реализации, рассказываем в статье.
Содержание:
- Лучевая терапия при онкологии: радиохирургия, гамма-ножи и линейные ускорители
- Виды лучевой терапии
- Радиохирургия для лечения опухолей
- Дистанционная лучевая терапия
- Протонная лучевая терапия
- Таргетная и иммунотерапия для лечения рака
- Заключение
Виды лучевой терапии
Радиотерапия может быть самостоятельным методом лечения или применяться в составе комплексной терапии совместно с хирургическим, химиотерапевтическим и иммунологическим воздействиями.[6] Особенно ценной она оказывается при наличии ограничений для оперативных вмешательств и применения высоких доз цитостатиков.[7]
В зависимости от целей использования лучевую терапию подразделяют на:
- Радикальную. Она ставит своей задачей полное излечение пациента от онкологического заболевания.
- Паллиативную. Предназначена для приостановления роста неоперабельной опухоли, уменьшения ее размеров, количества и протяженности метастазов для улучшения состояния пациента и повышения качества дожития.
- Симптоматическую. Используется для купирования некоторых симптомов, обусловленных объемом опухоли, и отягчающих состояние пациента (например, болевого синдрома, синдрома сдавления верхней полой вены и т. д.).
- Предоперационную. Применяется с целью сокращения размеров опухоли для снижения риска осложнений при ее близком расположении к анатомически важным структурам, а также для уменьшения риска миграции онкоклеток в окружающие ткани.
- Профилактическую. Необходима для предупреждения рецидивирования опухолевого процесса через облучение зон регионарного лимфооттока и ложа удаленной опухоли.[8]
Еще одна классификация предполагает разделение методов лучевой терапии по техническим особенностям ее проведения:
➔ Дистанционная лучевая терапия — вариант лечения, при котором ионизирующее излучение подается на патологические ткани с некоторого расстояния и бесконтактно. Дистанционная лучевая терапия подразделяется на:
- Радиохирургию — высокие дозы ионизирующего излучения подводятся единоразово или в несколько серий. Эта технология используется в гамма-ноже и кибер-ноже.
- Лучевую терапию на линейном ускорителе. Метод заключается в серийном воздействии умеренных доз фотонов (для глубоких структур) или электронов (для поверхностно расположенных опухолей).
- Протонную терапию — наиболее эффективный и точный метод дистанционного лучевого лечения, применяемый в основном для терапии диссеминированных поражений головного и спинного мозга.
- Рентгенотерапию — способ лечения, предполагающий воздействие на патологический очаг рентгеновскими лучами низкой и средней энергий. Может использоваться как при онкопроцессах, так и при неопухолевых поражениях кожи и слизистых оболочек воспалительного, атрофического или гипертрофического характера. Выделяют два вида рентгенотерапии:
➢ Близкофокусная (короткофокусная). Лечение осуществляется рентгеновскими лучами малой и средней энергии и используется для ликвидации поверхностно расположенных (до 12 мм) поражений кожи и слизистых оболочек гениталий, конъюнктивы и ротовой полости.
➢ Глубокая (ортовольтная). Рентгенотерапия проводится лучами более высокой мощности и применяется для уничтожения глубоко расположенных опухолей кожи, первичных очагов и метастазов костей.[9]
➔ Контактная лучевая терапия — вид лучевого лечения, при котором источник ионизирующего облучения напрямую контактирует с поврежденными тканями. Различают несколько разновидностей этого метода:
- Брахитерапия (внутритканевая лучевая терапия), при которой радиоактивные элементы (интростаты, заполненные изотопами радия, кобальта, йода, цезия и т. д.) вживляются в опухолевую массу или помещаются вблизи нее.
- Аппликационная лучевая терапия — радиоактивные накладки-аппликаторы располагаются непосредственно на поверхностности опухоли кожи и слизистых оболочек наружных половых органов.
- Внутриполостная лучевая терапия — источник ионизирующего излучения (эндостат, заполненный радионуклидами) вводится в просвет полых органов (полость матки, влагалище, мочевой пузырь, прямую кишку, пищевод) для лечения онкопроцесса их слизистой оболочки.
➔ Радионуклидная лучевая терапия — метод, основанный на введении в организм радиофармацевтического препарата (РФП). Радиофармацевтический препарат представляет собой раствор радионуклидов, способных прицельно накапливаться в опухолевой массе. Чаще всего такой способ лечения реализуется при опухолях щитовидной железы и онкологическом поражении костной ткани. В первом случае внутривенно вводится радиоактивный йод, который избирательно захватывается тиреоидными клетками. Во втором случае используют остеотропные радиофармпрепараты. Реже применяется радиоиммунотерапия — радионуклиды прикрепляются на моноклональные противоопухолевые антитела, чтобы добиться прицельного радиологического воздействия на онкоклетки.[10]
➔ Гипертермия. Метод заключается в воздействии на организм повышенных температур, в результате чего укрепляется иммунная система и разрушаются раковые клетки.
Радиохирургия для лечения опухолей
Радиохирургия — один из современных методов лечения, в основе которого лежит прицельное подведение повышенной дозы ионизирующего излучения на участок патологического процесса. При этом доза облучения настолько велика, что вызывает гибель онкоклеток за один сеанс. Реже может понадобиться несколько фракций — сеансов радиохирургии.[11]
В отличие от малых доз ионизирующего излучения, направленных преимущественно на повреждение ДНК онкоклетки, большие дозы, подводимые с помощью облучателей современных линейных ускорителей, обладают рядом дополнительных механизмов повреждения, определяющие столь высокую эффективность данного метода лечения:
- разрушение сосудистого компонента опухолевого микроокружения (дозы >10 Гр вызывают быстрый апоптоз клеток эндотелия) с нарушением трофики новообразования;
- деградация и снижение способности к пролиферации радиорезистентных опухоль-ассоциированных фибробластов (CAFs-клеток), играющих важную роль в процессах клеточного роста, ангиогенеза и инвазии;
- стимулирование выработки CD8+Т-лимфоцитов, выполняющих важнейшую функцию в процессе иммунного ответа на онкопроцесс.[12]
В зависимости от особенностей применения среди методов радиохирургии различают «гамма-нож» и «кибер-нож».
Гамма-нож
Гамма-нож — высокоточный неинвазивный метод лечения опухолей головного мозга и области шеи. То есть, его применение не требует вскрытия черепной коробки и минимально затрагивает окружающие здоровые ткани, чего невозможно достичь традиционными нейрохирургическими способами лечения онкологии данной локализации.
Суть метода «Гамма-нож» заключается в дистанционном направленном воздействии на опухоль гамма-облучения изотопов кобальта высокой мощности. В большинстве случаев достаточно однократного проведения процедуры. Высокая точность определения мишени и минимизация осложнений достигаются за счет использования принципа стереотаксиса.
Под стереотаксисом понимают четкое позиционирование опухоли в трехмерной системе координат, созданной с помощью жесткой рамы, которая крепится к черепу пациента. Далее встроенный вычислительный комплекс аппарата рассчитывает прохождение каждого гамма-луча так, чтобы их пересечение концентрировалось в изоцентре — зоне максимальной дозы ионизирующего излучения. Современные установки позволяют врачу сопоставлять и комбинировать множество изоцентров для создания мишеней сложной формы и конфигурации, чтобы максимально охватить опухолевую зону без затрагивания здоровых тканей.[13]
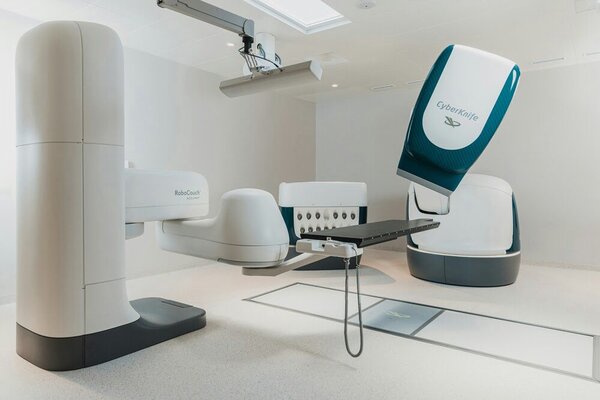
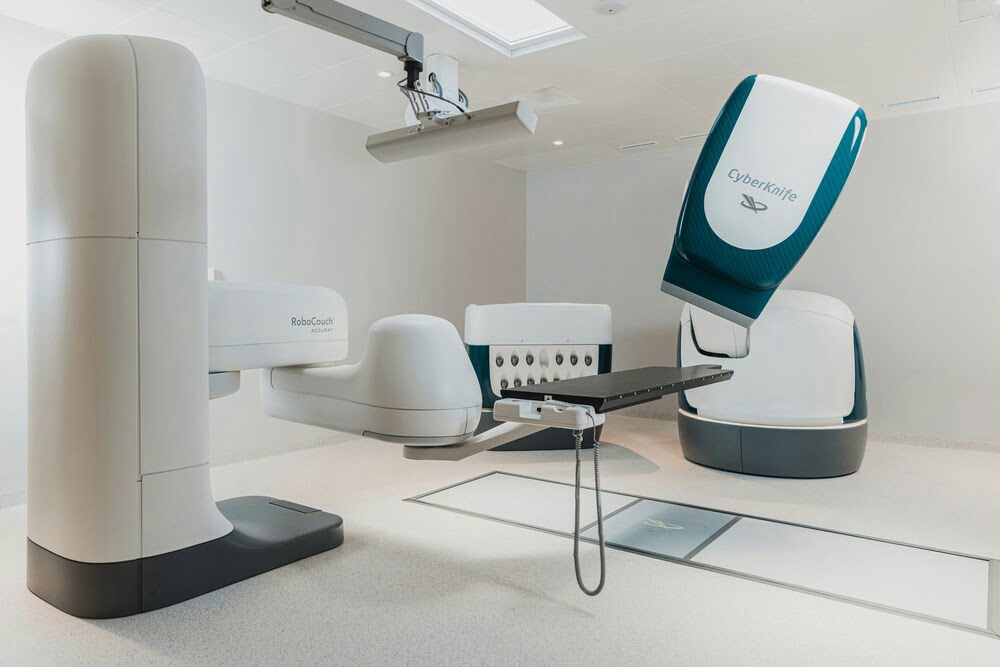
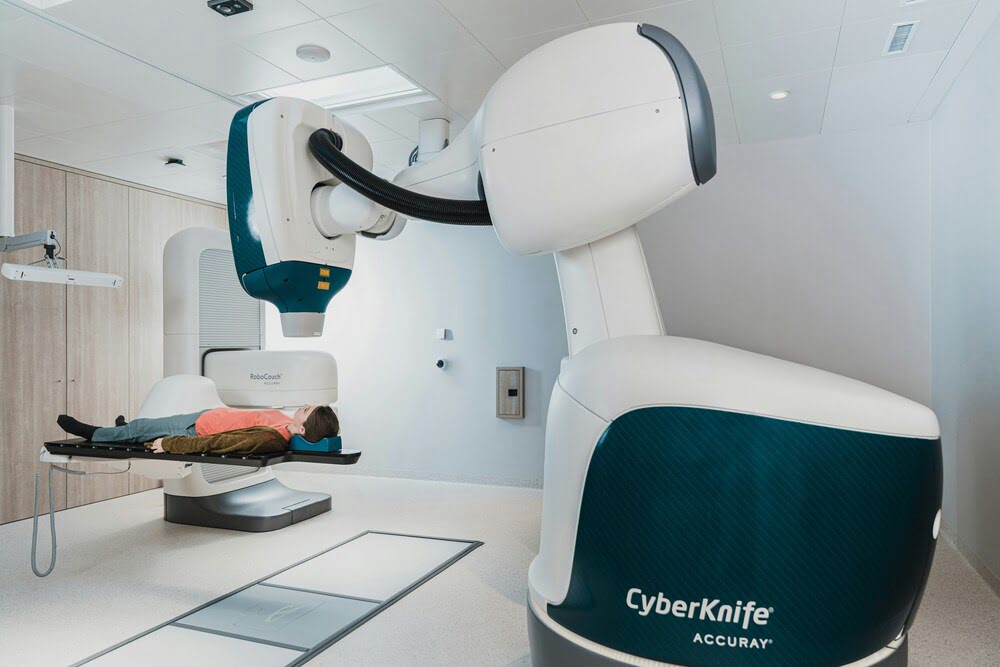
Кибер-нож
Кибер-нож — это метод лучевой терапии, позволяющий неинвазивно удалять новообразования труднодоступных локализаций за счет облучения опухолевой массы высокоэнергетическими фотонными потоками. Благодаря развитию технологий стереотаксиса, позволяющих осуществлять позиционирование без использования жесткой рамы, кибер-нож может применяться для лечения опухолей любого участка тела.[14]
Вместо жесткой рамки для позиционирования в технологии «Кибер-нож» используется система координат, рассчитанная по расстоянию от известных анатомических образований (в частности, костных ориентиров). А для подвижных опухолей, находящихся, например, в грудной клетке и меняющих свое положение в пространстве в ходе акта дыхания, могут применяться рентгеноконтрастные «метки». Обычно в их роли выступают золотые частички, которые заранее вживляются в опухоль. Специальное программное обеспечение кумулирует данные системы слежения и позволяет компенсировать смещение тела пациента и точно позиционировать каждый луч в режиме реального времени.
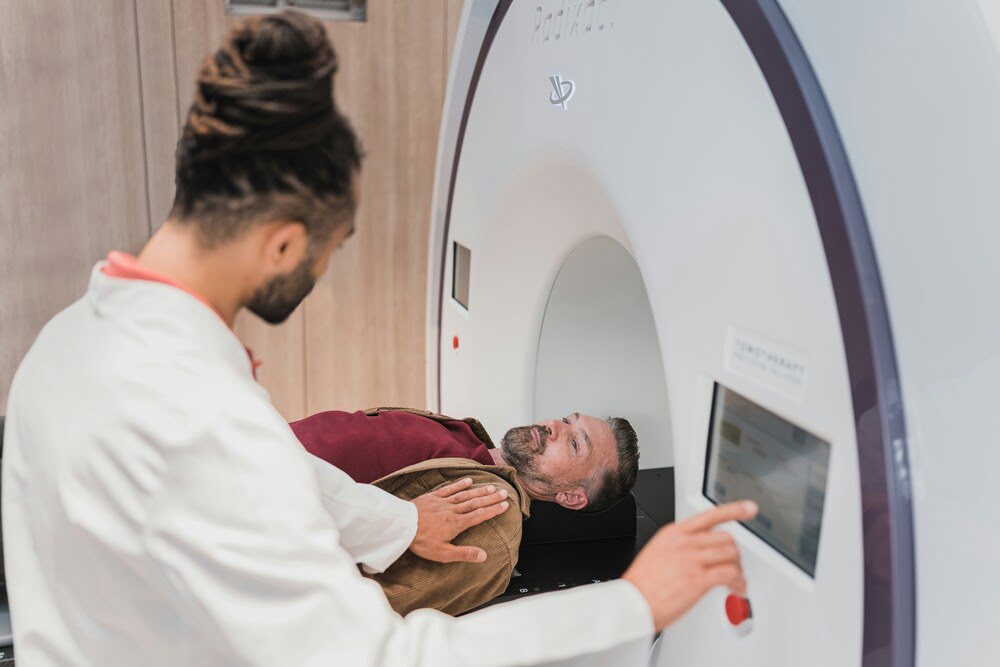
Дистанционная лучевая терапия
Дистанционная лучевая терапия — самый распространенный вид радиотерапии, который используется у большинства онкопациентов во всем мире и по праву считается основным методом лечения опухолей головы и шеи.[15] В качестве ионизирующего излучения могут применяться потоки фотонов или корпускулярных частиц (электронов, протонов или нейтронов). Выбор оптимального облучателя зависит от характера опухоли.
Фотонное излучение отличает прекрасная глубина проникновения, однако применение данного вида облучения часто сопряжено с повреждением интактных тканей. В свою очередь, электронное облучение имеет низкую проникающую способность и поэтому обычно используется для ликвидации поверхностных опухолей. Активно изучается потенциал протонной терапии, так как данный вид излучения отличает высокая прицельность воздействия на глубоко расположенные образования при минимальном травмировании здоровых тканей.
Так как в большинстве случаев на пути радиоволн находятся здоровые ткани, которые могут повреждаться в ходе лечения, совершенствование данного направления терапии онкологических заболеваний нацелено на разработку технологий, минимизирующих риск повреждения интактных областей за счет концентрации ионизирующего излучения непосредственно на мишени (опухолевой ткани). В последние годы дистанционная лучевая терапия получила мощный толчок к развитию за счет разработки высокоэнергетических линейных ускорителей, что позволило существенно улучшить технические параметры радиационного лечения и значительно снизить риск развития осложнений.[16]
Возможности линейных ускорителей
Эффективность и безопасность линейного ускорителя определяется его функциональными возможностями, а именно способностью точно локализовать патологический участок и доставить к нему достаточную дозу облучения для радикального уничтожения опухолевой массы без вовлечения окружающих здоровых тканей.[17]
Качество радиационного лечения на линейном ускорителе во многом зависит от наличия современного коллиматора — устройства, которое формирует размер и форму поля облучения. Коллиматоры последнего поколения позволяют создавать поля неправильной формы, многофокусные поля, неизорцентрические поля со смещенным фокусом максимального воздействия. А коллиматоры с переменной апертурой могут менять форму и размер поля в режиме реального времени, что позволяет не прекращать процедуру для перенастройки аппарата и значительно сокращает продолжительность терапии.[18]
Для точного позиционирования мишени (опухоли) современные линейные ускорители имеют несколько вариантов визуализации. Мегавольтная или портальная визуализация позволяет получать двухмерный снимок пациента (2D-конформная лучевая терапия). Более совершенной технологией являются киловольтные визуализирующие системы, которые генерируют снимки лучшего качества и используются для выполнения сканирующей компьютерной томографии в коническом пучке (CBCT). Полученная совокупность снимков с помощью программного обеспечения сопоставляется с томограммами, выполненными перед началом лечения, что создает трехмерное изображение патологического очага (3D-конформная лучевая терапия). Эта технология помогает правильно расположить пациента перед процедурой.[19]
Оптимизация пространственного распределения дозы в современных линейных ускорителях реализуется через технологию модуляции интенсивности облучения — Intensity-Modulated Radiation Therapy, IMRT. Она позволяет регулировать интенсивность лучей внутри каждого облучаемого поля. Такое воздействие минимизирует риск повреждения здоровых тканей, одновременно усиливая облучение в зоне опухоли.
Облучение мишеней сложной конфигурации улучшается с помощью технологии объемно-модулированной лучевой терапии — Volumetric Modulated Arc Therapy, VMAT. Однако для реализации этой возможности требуются специальные спиральные ускорители, которые способны генерировать динамичное лучевое поле путем корректировки скорости вращения ускорителя, параметров коллимационной системы и силы лучевого пучка в реальном времени.
Кроме того, разработаны системы, позволяющие лечить движущиеся мишени, не прибегая к традиционным методам синхронизации и задержки дыхания.[20] Для этого используется лучевая терапия с контролем образов — Image-Guided Radiation Therapy, IGRT.[21]
Совокупное использование всех перечисленных технологий позволяет чрезвычайно точно сформировать мишень, к которой будет подводиться облучение, и дает возможность проведения стереотаксической радиохирургии — Stereotactic Radiosurgery, SRS и стереотаксической радиотерапии — Stereotactic Radiotherapy, SRT.[22] [23]
Производители линейных ускорителей
На сегодняшний день на рынке медицинской аппаратуры есть производители, разрабатывающие аппараты для проведения лучевой терапии, которые могут с успехом применяться в онкологических, дерматологических и косметологических клиниках.
Линейные ускорители компании Siemens (Германия) отличают компактный дизайн, высокая надежность и точность настройки параметров всех модулей, в том числе и многолепесткового коллиматора. Ускорители Siemens — это многофункциональные радиотерапевтические устройства, которые позволяют решать различные клинические задачи, учитывая финансовые возможности клиники и пациента.
Серия линейных ускорителей компании Elekta (Швеция) — это высокотехнологичное оборудование, позволяющее проводить облучение фотонами и электронами разных энергий. Производитель реализовал в своих устройствах технологию 3D-конформной визуализации, что значительно повышает эффективность и безопасность метода.
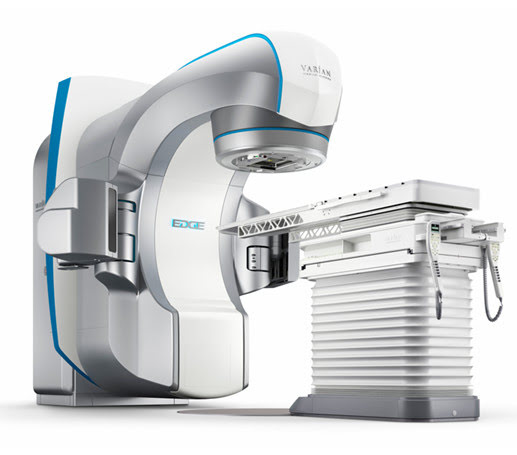
Лидером на рынке оборудования для лучевой терапии продолжает оставаться компания Varian Medical Systems (США), которая много лет сохраняет за собой позиции новатора в области радиотерапии. Современные линейные ускорители данного производителя — это высокоэнергетические устройства, оснащенные передовыми технологиями, включая IMRT, IGRT, VMAT, SRS, дополненные системой расширенной визуализации PortalVision aS1000 и удобным программным обеспечением.
В лучевых ускорителях для лучевой терапии Edge от компании Varian Medical Systems реализован весь спектр возможностей современной радиохирургии, что позволяет проводить лечение максимально точно и комфортно для пациента.
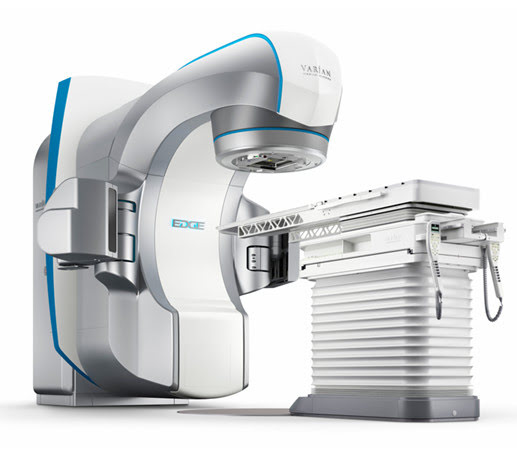
Линейный ускоритель Halcyon — одна из лучших разработок компании. Аппарат может быть смонтирован как в специализированных помещениях, так и в каньонах, где ранее размещалась другая радиотерапевтическая техника. Это позволяет значительно снизить экономические затраты на обновление парка оборудования.
Линейный ускоритель TrueBeam — флагман Varian Medical Systems, предназначенный для проведения как радиотерапевтического, так и радиохирургического лечения онкологических заболеваний с максимальной защитой интактных тканей. Совершенный визуальный контроль в ходе процедуры позволяет врачу оперативно корректировать процесс терапии без ее остановки.
Протонная лучевая терапия
Протонная терапия — это метод лучевого лечения, в котором для генерации ионизирующего излучения используются протонные ускорители — циклотроны и синхротроны. Благодаря ряду физических особенностей, в первую очередь наличию пика Брэгга, протонное излучение обладает лучшим распределением дозы в здоровых тканях организма. Это особенно важно при близком расположении к опухоли критических с точки зрения радиочувствительности образований, поскольку значительно снижает частоту и выраженность радиоиндуцированных реакций.
Кроме того, энергия протонного излучения позволяет более эффективно воздействовать на медленнорастущие, рецидивные и радиорезистентные опухоли.[24] То есть, протонная терапия одновременно является как более щадящим методом, который дает возможность уменьшить токсичность радиационного воздействия, так и более эффективным в плане улучшения результатов лечения онкологических больных.[25] Наиболее широкое распространение эта технология получила для лечения сложных, первично диссеминированных опухолей головного и спинного мозга у детей , а также множественных метастазов нервной системы.
Практически все современные протонные ускорители оснащены технологией объемно-модулированной лучевой терапии (IMRT). Она предполагает формирование тонких пучков протонов с индивидуальной энергией, которые способны проникать на различную глубину в тканях организма. С помощью системы магнитов траектория движения пучков отклоняется под разными углами, позволяя протонам постепенно заполнять весь объем опухоли-мишени без превышения радиотолерантности окружающих тканей.[26]
Таргетная и иммунотерапия для лечения рака
В комбинации с лучевым лечением при онкологии нередко применяются иммунотерапия и таргетная терапия.
Иммунотерапия — метод лечения, который активирует иммунную систему организма для борьбы с опухолями. Вместо того, чтобы напрямую атаковать новообразование, иммунотерапия стимулирует иммунную систему для более эффективного уничтожения опухолевых клеток. Одним из наиболее обещающих подходов к иммунотерапии является использование ингибиторов контроля, которые предотвращают выключение иммунной системы и способствуют ее продолжительной борьбе с опухолью.
Молекулярно-целенаправленная терапия (таргетная терапия) — метод лечения, направленный на устранение приводящих к развитию опухолей генетических мутаций. Это достигается путем использования лекарственных средств, которые подавляют конкретную мутацию в опухолевых клетках. Таргетная терапия позволяет более эффективно лечить первично диссеминированные злокачественные опухоли.[27]
Заключение
➢ Лучевая терапия — важная составляющая лечения онкологических больных, которая позволяет значительно улучшить показатели выживаемости данной категории пациентов и обеспечивает неинвазивное, быстрое и комфортное уничтожение онкоклеток физическими методами с минимальным количеством побочных эффектов.
➢ Реализация возможностей радиолечения осуществляется за счет современных линейных ускорителей, наличие которых характеризует высокотехнологичную направленность клиники.
➢ В свою очередь, применение рентгенотерапевтических установок будет полезным в дерматологических и косметологических клиниках для терапии неопухолевых образований кожи.